martes, 3 de noviembre de 2009
Farmacos Nefrotoxicos en la Insuficiencia renal
Exposición del Dr. Alonso Vega Acuña de la Clinica Betesda para el Programa La Voz del Pueblo Costa Rica
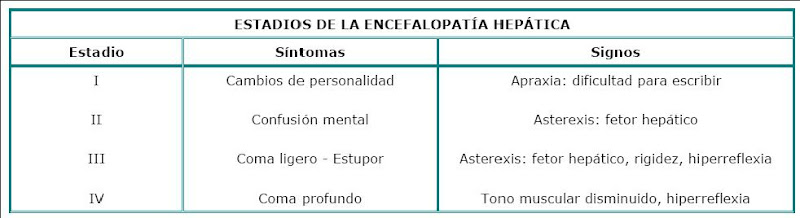
ESTADIOS DE LA ENCEFALOPATÍA HEPÁTICA
- La encefalopatía hepática es un síndrome de alteración mental que aparece en pacientes
con insuficiencia hepática aguda o crónica. En algunos casos raros puede ocurrir en
ausencia de daño hepático (síndromes hiperamoniémicos). - La encefalopatía hepática aguda se presenta en casos de necrosis hepática masiva
asociada con infecciones virales, fármacos, tóxicos, o con esteatosis micronodular que
suele presentarse con medicamentos, como las tetraciclinas, administrados por vía
intrevenosa o en el hígado graso del embarazo. Las manifestaciones clínicas son diversas
y varían desde cambios sutiles de la personalidad hasta el coma profundo.
• El diagnostico de la Encefalopatía Hepática es fundamentalmente clínico, asociado a
análisis de laboratorio y otras técnicas para exclusión de otras causas que determinan un
cambio en el estado mental, dado que las características clínicas objetivadas en EH no
son especificas y por tanto aparecen en otras entidades tales como hipoxia, acidosis,
tóxicos…
• Cabe reseñar que no hay estudios que validen esta escala que fue diseñada en 1979 (2)
y que posee como mayor inconveniente la subjetividad a la hora de analizar sus
parámetros. No obstante, con la progresión de la encefalopatía, las anormalidades
neurológicas retornan mucho más aparentes y pueden ser graduadas con esta escala,
reflejando el incremento de la disfunción hepática. A pesar de que las características
clínicas pueden ser reversibles con tratamiento, generalmente el grado de encefalopatía
es una manifestación de enfermedad hepática avanzada, y por tanto asociada a un peor
pronóstico a largo plazo, siendo la presencia de EH indicación de transplante.
Clasificación de Child-Pugh
Esta escala nació para evaluar el pronóstico de los pacientes sometidos a cirugía.
Se aplica sólo a pacientes con cirrosis hepática.

| Clase | Puntaje | Sobrevida 1 año | Sobrevida 2 años |
| A | 5-6 | 100 | 85 |
| B | 7-9 | 80 | 60 |
| C | 10-15 | 45 | 35 |
miércoles, 21 de octubre de 2009
domingo, 11 de octubre de 2009
viernes, 2 de octubre de 2009
viernes, 18 de septiembre de 2009
Cancer de ovario
cancer ovario, ginecologia
jueves, 17 de septiembre de 2009
CÁNCER DE ENDOMETRIO
El adenocarcinoma de endometrio supone el tercer cáncer en frecuencia en el mundo occidental para el sexo femenino, siendo una de sus principales características su buen pronóstico, ya que el 80% se diagnostican en estadio I. La mayoría de ellos son hormonodependiente, por lo que los estímulos estrogénicos mantenidos favorecerán su aparición. De hecho en la década de los 70 se objetivó un aumento en la incidencia de este carcinoma, debido a la instauración del tratamiento hormonal sustitutivo en mujeres perimenopaúsicas. Además el uso del tamoxifeno, un estrógeno débil, se asocia a incrementos en la tasa de cáncer de endometrio. El principal síntoma de alarma es la metrorragia postmenopáusica, que es motivo de consulta médica y factor relevante en la precocidad del diagnóstico en la mayoría de los casos. Este hecho conlleva altas tasas de supervivencia en estadíos precoces, cuando el tratamiento es la cirugía sola o, asociada a radioterapia pélvica y braquiterapia endocavitaria, en casos con factores pronósticos adversos. En estadios mas avanzados (II-IV) la posibilidades de supervivencia empeoran progresivamente. La hormonoterapia con progestágenos es el tratamiento sistémico indicado en la mayoría de las situaciones de enfermedad diseminada, aunque en algunas situaciones, la quimioterapia constituye una alternativa terapéutica. No existen programas de screening adecuados para este tumor. Las recomendaciones para prevención primaria en cuanto a hábitos de vida, podrían contribuir a un descenso en su incidencia.
2. EPIDEMIOLOGÍA
Representa en USA el 6% de todos los tumores, siendo el cuarto cáncer en tasa de incidencia. En la provincia de Las Palmas es el segundo cáncer femenino en tasa de incidencia (9%) solo detrás del cáncer de mama. Es un tumor de buen pronóstico, ya que se diagnostica generalmente en etapas precoces (80% estadío I), siendo responsable solamente del 3% de las muertes por cáncer. Su pico deincidencia está entre los 50-70 años, diagnosticándose el 75% en mujeres postmenopaúsicas. Se objetivó un incremento en la incidencia del cáncer de endometrio a mediados de la década de los 70, coincidiendo con el inicio de la terapia hormonal sustitutiva en mujeres perimenopaúsicas. Es un tumor con dependencia hormonal, de manera que, ante cualquier estímulo estrogénico mantenido sin aumento de la exposición a progesterona, se facilitará el desarrollo de la enfermedad. Por el contrario en los sarcomas uterinos, el único factor etiológico documentado en el 15-25% de los casos es la irradiación pélvica previa, por metrorragias benignas, más de 25 años atrás, si bien en ninguno de los 57 casos de sarcoma (entre los 606 casos de cáncer de útero diagnósticados en la Provincia de Las Palmas entre 1994 y 2003) tenía este antecedente.
- Tratamiento de estrógenos sin gestágenos como tratamiento hormonal sustitutivo en mujeres perimenopaúsicas. Factor de riesgo 4.5-8, que aumenta hasta 30 si se realiza durante más de 5 años. Nivel de evidencia 1 (estudios randomizados).
- Tamoxifeno: es un agonista parcial estrogénico, con acción proliferativa sobre el endometrio. Factor de riesgo 2.5-7. El riesgo es superior en mujeres mayores de 50 años. Nivel de evidencia 1 (estudios randomizados).
- Hiperplasia endometrial (HE): tendencia a progresar a carcinoma. En casos de HE sin atipias el riesgo de progresar a carcinoma es del 2%, si la HE es simple atípica progresará un 8%, y si la HE es compleja atípica la posibilidad de desarrollar un cáncer de endometrio será del 23%.
- Obesidad: en parte debido a la conversión periférica de estrógenos. Factor de riesgo 2-10. Nivel de evidencia 3 (casos-control).
- Diabetes Mellitus: en el 10-20% de mujeres con carcinoma de endometrio. Factor de riesgo 2.8.
- Nuliparidad: en el 50% de pacientes.
- Factores hereditarios: se ha visto que un 10-30% de las pacientes tenían antecedentes familiares de cáncer.
- Síndrome del cáncer colorrectal no poliposo: en las mujeres que lo padecen, existe un riesgo acumulado de presentar carcinoma de endometrio a la edad de 70 años del 20-60% .
Resulta evidente de todo lo anterior el papel relevante que la estimulación estrógenica tiene en la promoción de los tumores endometriales. Estas exposiciones pueden ser de carácter natural como la menarqia precoz o la menopausia tardía o la nuliparidad, como la administración exógena de sustancias con actividad estrogénica.
4. HISTORIA NATURAL
El carcinoma de endometrio se origina en el revestimiento epitelial de la cavidad uterina. El tumor que crece infiltrando localmente la pared del útero, afectando progresivamente a las capas musculares y posteriormente a la serosa. La capacidad de infiltración está relacionada con el grado de
diferenciación tumoral. En tumores bien diferenciados el crecimiento se suele limitar a la superficie endometrial, mientras que es frecuente la invasión del miometrio en los tumores poco diferenciados. A partir de ahí, por contigüidad, afectará al cérvix, vagina, parametrios, vejiga , recto. La infiltración de la pared uterina se relaciona con la probabilidad de afectación ganglionar. Así, el riesgo de metástasis ganglionares aumenta cuando la infiltración del miometrio es mayor del 50%, empeorando el pronóstico.
Los estadios I tienen un 10% de metástasis ganglionares, mientras en el estadio II alcanza el 36%. Así por vía linfática afectará fundamentalmente a los ganglios pélvicos (la mayoría y los primeros afectados) y luego a los ganglios paraórticos. La diseminación por vía sanguínea es poco frecuente, ya que la mayoría se diagnostican en el estadio I. Las localizaciones mas frecuentes son pulmón, hígado, cerebro, ganglios supraclaviculares e inguinales y huesos. Finalmente la diseminación peritoneal es característica en este tipo de tumor, aunque no habitual, lo que obliga durante el acto quirúrgico a hacer un lavado peritoneal con citología y biopsia de epiplon, para descartar su afectación. Es más frecuente en el carcinoma de células claras y en el carcinoma papilar seroso.
La conducta biológica de los sarcomas difiere de la de los carcinomas de útero. Los sarcomas presentan afectación ganglionar al inicio del 25-50%, pudiendo desarrollar metástasis rápidamente por vía hematógena, especialmente al pulmón (50-80%), con lo que su pronóstico es siempre peor.
5. TIPOS HISTOLÓGICOS
Los tumores pueden ser epiteliales (adenocarcinomas fundamentalmente) o sarcomas (provienen de células mesenquimales de la pared muscular del útero, el miometrio). Los tipos histológicos más frecuentes son:
- Adenocarcinoma ciliado
- Adenocarcinoma secretorio
- Adenocarcinoma papilar o villoglandular
- Adenocarcinoma con diferenciación escamosa: con elementos tumorales derivados del epitelio glandular y del escamoso).
- Adenoacantoma
- Adenoescamoso
- Sarcomas: 2-5% de los tumores uterinos. Según su origen distinguimos entre leiomiosarcoma (procedente del músculo miometrial) y mesodérmico o sarcoma estromal (procedente del epitelio del endometrio). Las variantes más frecuentes son:
• Carcinosarcoma (sarcomas mesodérmicos mixtos). Constituyen el 50%
• Leiomiosarcoma (30%)
• Sarcoma del estroma endometrial (15%)
6. DIAGNÓSTICO
-Historia Clínica: El diagnóstico de cáncer de endometrio, se sospecha en toda mujer peri-postmenopáusica con metrorragia. El 28% de estas metrorragias es debido a un proceso neoplásico, el 50% son de origen endometrial (hiperplasia, pólipos) y el 28% de origen cervical. Hay que investigar sobre los posibles factores de riesgo tanto endógenos (el prototipo de mujer con cáncer de endometrio es una mujer postmenopáusica, obesa, hipertensa, diabética con metrorragia) como exógenos (terapia hormonal susutitutiva, tamoxifeno). En estadios avanzados ya pueden existir otros síntomas como dolor pélvico-lumbar, piometra o hematometra .
-Exploración física, tanto general como ginecológica (inspección, palpación,...) Se puede evidenciar sangre en OCE (orificio cervical externo) y/o vagina, aumento del tamaño uterino...
-Ecografía transvaginal: engrosamiento del endometrio. Ante un grosor endometrial mayor de 5 milímetros en una mujer postmenopáusica se deberá hacer una histeroscopia para descartar hiperplasia o carcinoma.
-Citología vaginal: sólo el 30% presentan citología positiva. Sin embargo podría ser importante, ya que en un estudio retrospectivo, se observó correlación entre citología positiva y enfermedad de alto riesgo.
- Histeroscopia + biopsia: es el método diagnóstico definitivo. Se toman muestras para biopsia de las zonas sospechosas. Si no se dispone de histeroscopia se hará un legrado fraccionado del endocérvix y del endometrio.
- Estudio de extensión, se realiza tras confirmar el diagnóstico. Incluye TAC abdomino-pélvico, para valorar la extensión del tumor en el útero y estructuras adyacentes, adenopatías, hígado... La RMN parece aportar más datos sobre la extensión intrapélvica y la infiltración miometrial. También se hace una radiografía de tórax, que nos sirve para el preoperatorio y para descartar metástasis pulmonares. Ante sospecha clínica o en estadios avanzados se hará rectoscopia, enema opaco o cistoscopia, para descartar la afectación de recto y/o vejiga. La gammagrafía ósea se realizará solo en
casos de sintomatología sospechosa
7. ESTADIAJE
En aquellas pacientes no quirúrgicas se utiliza el estadiaje clínico de la Federación Internacional de Ginecología y Obstetricia (FIGO). Se utilizarán los hallazgos de la histerectomía en las pacientes intervenidas, siguiendo los criterios de la clasificación de la FIGO (1992) y del Comité Estadounidense Conjunto sobre el Cáncer (AJCC, 2002). Los sarcomas uterinos se estadían siguiendo los criterios de clasificación de la FIGO para carcinoma de endometrio. Según el grado de diferenciación se puede clasificar en G1: 5% o menos de las células tienen crecimiento sólido no escamoso, G2: de 6-50% de las células tienen crecimiento sólido no escamoso y G3: >50% de las células tienen crecimiento sólido no escamoso.
8. FACTORES PRONÓSTICOS
- Estadio: La extensión de la enfermedad es siempre el principal factor pronóstico. En casos limitados al útero (estadio I) la invasión miometrial supone una mayor incidencia de afectación ganglionar y de metástasis, independientemente del grado de diferenciación.
- Tipo histológico: Los papilares serosos y los de células claras entrañan el peor pronó.
- Grado de diferenciación: relevante en los estadios I. Los tumores bien diferenciados suelen tener menor tendencia a la invasión y propagación ganglionar, mientras que en los G3 es frecuente la invasión miometrial y ganglionar .
- Nivel de Receptores de Progesterona: para algunos autores es el principal factor pronóstico en estadios I y II, de manera que el 93% de las pacientes con niveles por encima de 100 ftm permanecían sin enfermedad a los 3 años frente sólo 36% de las que tenían niveles inferiores a 100 ftm.
- Invasión vascular-linfática: se correlaciona con un incremento en la afectación ganglionar y extrauterina.
- Proliferación tumoral aumentada (fracción elevada de fase S), aneuploidia y sobreexpresión her-2/neu, entre otros, implican un peor pronóstico.
domingo, 26 de julio de 2009
Sindrome nefrótoco en pediatría
Mario H. Encinas Arana*
INTRODUCCIÓN:
El término síndrome nefrótico (SN) es aplicable a cualquier condición clínica con proteinuria masiva, hipoproteinemia, hiperlipidemia y edema (1). Consiste en un desorden de permeabilidad selectiva que puede ser primario (85-90%) o secundario (10-15%) en el contexto de una enfermedad sistémica. En niños la variedad de SN más frecuente es aquella caracterizada por cambios histológicos mínimos en el glomérulo con el microscopio de luz: síndrome nefrótico a cambios mínimos (SNCM) y con respuesta a la corticoterapia o corticosensible (2,3). Los niños con SN resistente a los esteroides pueden tener diferentes patrones histológicos que incluyen a la glomeruloesclerosis focal y segmentaria (GEFS) y la mayor diferencia se observa en la progresión de la GEFS a la enfermedad renal terminal, lo cual raramente ocurre en el SNCM. Sin embargo, existe consenso en englobar ambas patologías dentro del síndrome nefrótico idiopático (SNI) y a clasificar a los pacientes según la respuesta a los esteroides y al patrón histológico (4,5).
EPIDEMIOLOGÍA
La incidencia mundial del SN en pediatría es de 2 a 7 x 100 000 en la población general, y la prevalencia en niños menores de 16 años de edad es de 15 x 100 000 habitantes con una prevalencia acumulativa de 15,7 por 100 000 niños. Un niño en seis mil desarrolla SN (5). La Asociación Internacional para el Estudio de las Enfermedades Renales (AIER), reportó 471 niños en los cuales el 78,1% con SN primario respondió a la corticoterapia y de estos el 91,8% tuvieron histología de cambios mínimos. El SN suele aparecer principalmente en niños de 2 a 8 años con una máxima incidencia de los 3 a los 5 años de edad (1). El 80% son menores 6 años al momento de la presentación con una media de 2,5 años para el SNCM y de 6 años para la GEFS (2).
Los varones son afectados más frecuentemente que las niñas, en una proporción de 1.8:1 aunque en adultos la proporción es igual. La incidencia familiar es del orden del 3,35% y existe una predisposición genética y factores ambientales determinantes en la distribución racial de esta enfermedad (6). Hay reportes de proteinuria estacional con sensibilidad al polen en pacientes previamente sanos (7). Además numerosos investigadores han encontrado que la atopía ocurre de 34 a 60% de los niños con SNCM con concentraciones muy altas de IgE (más de 1500 UI/l) asociado a frecuentes recaídas (7,8).
HISTOLOGÍA
Microscopio de luz: Es imperativo realizar varios cortes de cada biopsia y prepararlas adecuadamente ya que de no ser así las lesiones focales podrían perderse. Los podocitos citoplasmáticos aparecen edematosos o vacuolados. No se observa proliferación celular ni cambio de la matriz mesangial ni en asas vasculares. Striker sostiene que en su experiencia no ha observado que sus pacientes hayan progresado de cambios mínimos a cualquier enfermedad esclerosante o proliferativa(4). Hay datos recientes donde el incremento del tamaño glomerular sugiere la presencia de lesiones focales(9).
Inmunofluorescencia: El hallazgo característico de esta enfermedad es la ausencia completa de complejos inmunes, fibrina y otros materiales extraños. Algunos autores han descrito la presencia de IgM y C3 en cantidades mínimas. Lo esencial en las lesiones por cambios mínimos es la falta de depósitos en la membrana basal glomerular (MBG) determinando un patrón de inmunofluorescencia negativo(10).
Microscopio Electrónico: Los cambios a la microscopía electrónica están restringidos a las células epiteliales viscerales del glomérulo y por ello se denominó en algún momento “enfermedad de las células epiteliales” (9,11). La anormalidad característica del podocito es la completa fusión de los pedicelos, con una homogénea capa de citoplasma de células epiteliales sin interdigitaciones, con citoplasma vacuolado y abundantes organelas describiéndose una transformación microvellosa en la superficie urinaria de dichas células(13,15). La lámina rara externa, la lámina densa y la lámina rara interna aparecen normales así como la matriz y las células mesangiales(10,12).
FISIOPATOLOGÍA
El mecanismo fisiopatológico del SN involucra fundamentalmente una base genética predispo-nente además de presencia de células T anómalas con formación muy aumentada de IL-2 y de sus receptores y finalmente una disminución de la carga polianiónica de la membrana glomerular y aparición de proteinuria masiva(13,14).
1. Antígenos del Complejo de Mayor Histocompatibilidad (CMH)
Se han descrito marcadores genéticos del CMH en el cromosoma 6, para el SNCM tanto corticosensible como corticoresistente, con un aumento en la frecuencia de ciertos antígenos como HLA-B12, HLA-B8 y HLA-B27 aunque ninguno de estos tiene un valor predictivo sobre la remisión o recaídas. Se señala una asociación significativa entre el SN corticosensible y el HLA-DR7. En los pacientes corticoresistentes, la única asociación significativa fue la combinación DR3/DR7. Otros alelos aparecen como protectores, así la presencia de DR2 y el DR4 reduciría riesgo de desarrollar la enfermedad en los portadores DR7+(15).
2. Inmunofisiopatología
Se sugiere un mecanismo inmune relacionado a atopía (asma y eczema), variación estacional de las recaídas, susceptibilidad al neumococo, respuesta a los corticoides, a la ciclofosfamida y ciclosporina A, enfermedad de Hodgkin, y sarampión. Sobre estos conceptos, Shaloub(14) sugirió que el SNCM estaba causado por una linfoquina glomerulotóxica circulante producida por reservorios de células T aberrantes que activadas en el intersticio glomerular elaboran citoquinas (IL-1, IL-2), las que causarían aumento de la permeabilidad glomerular dando origen a la proteinuria. En la fase de recaída, hay un descenso de la IgG e IgA con elevación de la IgM y de la IgE(16,17).
3. Alteración de la barrera glomerular de filtración
El defecto funcional de la barrera glomerular causante de la proteinuria en el síndrome nefrótico corticosensible está mediado por linfoquinas, producidas por los linfocitos T activados a lo largo del desarrollo de la recaída (IL-2 y su receptor) las que elaboradas por células mononucleares activadas digerirían el proteinglucano heparansulfato, ocasionando una eliminación aumentada de glucosa-aminoglucano y de heparansulfato, que se normaliza con la remisión del cuadro. Se describe además una reducción de la carga normal de la barrera aniónica que puede ser neutralizada por sustancias de alta carga catiónica. El radio y la densidad de los poros moleculares están disminuidos(18,19).
4. Fisiopatología del edema:
Se involucran simultáneamente los mecanismos de underfill y de overflow. Su aparición en el SNCM se objetiva cuando la albúmina sérica es inferior a 2 g/dl, y tanto la ascitis como el derrame pleural aparecen cuando la albuminemia es inferior a 1,5 g/dl(20,24,26).
Hipótesis underfill o alteración del Equilibrio de Starling: Hay un aumento de las pérdidas urinarias de albúmina y el porcentaje del catabolismo renal de esta misma está muy elevado. Si bien en circunstancias normales el hígado es capaz de aumentar la síntesis de albúmina en un 300%, en el SNCM la recaída no logra contrarrestarlo. La hipoalbuminemia produce una disminución de la presión oncótica plasmática, favoreciendo el paso de líquido al espacio intersticial dando lugar a una situación de hipovolemia, lo que aumentaría la reabsorción renal de sodio y agua (cuando la presión oncótica es inferior a 8 mmHg siendo lo normal 25 mmHg), originando una reducción de la presión hidráulica intraglomerular, con la subsiguiente vasoconstricción de la arteriola eferente(19,21).
Hipótesis overflow, retención renal primaria de sodio: Algunos síndromes nefróticos tienen aumentada la volemia, sugiriendo que la retención de sodio/agua no es secundaria a la depleción intravascular, sino más bien a una alteración renal primaria, que daría lugar a una reabsorción inadecuada por alteraciones intrarrenales, factores hormonales circulantes o por efectos nerviosos; aunque los mecanismos y zonas tubulares afectadas aún están por determinar(22).
DIAGNÓSTICO:
Clínica.-El inicio está determinado por el desarrollo de edema progresivo y proteinuria selectiva. Ocasionalmente hipertensión arterial (HTA) y retención nitrogenada. Los eventos precipitantes son desconocidos salvo la asociación con reacciones alérgicas(23,24).
Signos vitales:
- Presión arterial normal o incrementada: Se describe un 20% de pacientes con HTA leve y transitoria en el SN. También se reporta hipotensión ortostática(24,25).
- Temperatura: Normal, a menos que coexista una infección.
- Frecuencia cardíaca: Taquicardia secundaria a disminución del volumen intravascular por disminución de la presión oncótica o por insuficiencia cardíaca congestiva.
- Frecuencia respiratoria: Incrementada si hay edema masivo con efusión pleural, embolia pulmonar, ascitis, gasto cardíaco disminuido o insuficiencia cardíaca congestiva(26,27).
Examen físico:
- Edema: El edema ocurre de dos a cuatro semanas del inicio de la proteinuria y es inicialmente blando y matutino con tendencia progresiva y generalizada (fascies abotagada)(28).
- Clínica cardiovascular: Los ruidos cardíacos disminuidos de intensidad podrían significar derrame pericárdico y si están incrementados pueden relacionarse a edema pulmonar. Los pulsos periféricos pueden ser difíciles de localizar por el edema.
- Clínica respiratoria: La dificultad respiratoria si ocurre está asociada al edema severo o edema pulmonar. También puede indicar neumonía. El tromboembolismo ha sido reportado en el 30% de los pacientes con SN y un tercio de ellos desarrollan embolismo pulmonar.
- Clínica gastrointestinal: Puede observarse diarrea secundaria al edema de la mucosa intestinal o proceso infeccioso intercurrente. El dolor abdominal refleja edema de la pared intestinal o irritación del plexo mesentérico(24). La rigidez de la pared abdominal podría significar peritonitis. Ackerman reportó hepatomegalia en el 50% aproximadamente de los niños hospitalizados por SN y esplenomegalia en cuatro de once pacientes en dicha serie(28).
- Clínica genitourinaria: Puede haber edema escrotal, vulvar y en algunos casos linfedema. Ocasionalmente se puede observar hidrocele(29).
Laboratorio.
- Hematología: Puede ocurrir leucocitosis secundaria a infección y anemia por déficit de eritropoyetina. La prolongación del tiempo de sangría se ve en los estados de hipercoagulabilidad. El promedio de velocidad de sedimentación glomerular(VSG) está reportado en 67 mm/hr(30).
- Inmunoglobulinas: La concentración plasmática de IgG e IgA está disminuida y la IgM elevada. Hay un 25% de pacientes con niveles elevados de IgE(31).
- Bioquímica: La hiponatremia es secundaria al incremento del agua corporal total por secreción de la hormona antidiurética (ADH) en respuesta a la disminución de la presión oncótica y del volumen intravascular. Un incremento de la urea y creatinina puede ser notado si hay hipovolemia. Hay disminución de las proteínas séricas con albúmina inferior a 2,5 g/dL con edema, hipovolemia, hipotensión ortostática, hiperlipidemia e incremento de la toxicidad de drogas ligada a albúmina. La hiperlipidemia parece ser el resultado de tanto sobreproducción como disminución del catabolismo de las b-lipoproteínas. Los valores para hipercolesterolemia son de 300 mg/dL. Las lipoproteínas de baja densidad y los triglicéridos están precozmente elevados con incrementos variables en VLDL, LDL y fracciones de lipoproteínas de densidad intermedia. Los valores de HDL son usualmente normales(32). El calcio total plasmático está disminuido aunque el calcio ionizado es normal.
Examen de orina: La proteinuria en rango nefrótico es la presencia de más de 1g/l en una muestra de orina de 24 horas, la cual se correlaciona con una proteinuria mayor de 40 mg/m2SC/hora o relación proteína/creatinina en orina al azar >2 (Tabla 1). Se describe la presencia casi exclusiva de albúmina (más del 85%) y débiles trazas de globulinas beta, alfa 1 y 2. La hematuria microscópica está presente en el 23% de los pacientes con SN no complicado pero puede ser indicativo de otras enfermedades glomerulares, junto con la presencia de cilindros hemáticos. Un nivel de 1384 nmol de creatinuria tiene una sensibilidad de 45% y una especificidad del 92% en el diagnóstico de SNCM(11,33).
Tabla 1. Grados de proteinuria
 ( Click en la imgen para ampliar)
( Click en la imgen para ampliar)
Serologia: Debe descartarse secundarismo solicitando C3, células LE, ANA, ANCA, AgsHB, VDRL. Los niños con SNI tienen generalmente títulos de ASO <100.un>100 lleva a la consideración de otra enfermedad renal(34).
Estudio por imágenes.- Ecografia renal: Permite determinar la estructura y tamaño de los riñones y descartar obstrucción. Asimismo determina la presencia de dos riñones previo a la biopsia.
- Radiografía de tórax: Debe solicitarse en pacientes con síntomas de edema pulmonar insuficiencia cardíaca congestiva o de infección como neumonía. Puede observarse cardiomegalia, infiltrados difusos o parahiliares o efusión pleural con insuficiencia cardíaca congestiva. Debe descartarse también TBC pulmonar.
Diagnóstico diferencial.- Está dirigido al planteamiento de secundarismo como son colagenopatías (lupus eritosomatoso sistémico (LES), etc.) vasculitis (púrpura de Henoch-Schönlein), enfermedad de Wegener, panarteritis nodosa, etc., amiloidosis, síndrome urémico hemolítico, nefropatía por VIH, diabetes mellitus, lúes congénita entre otros.
Complicaciones.-El rango de mortalidad para SN es del 1 a 2%. Se señalan como complicaciones:
- Infecciones: El SN durante las recaídas tiene una susceptibilidad incrementada a las infecciones bacterianas severas en un 8%, debido al descenso de la inmunoglobulinas, la deficiencia proteica, la terapia inmunosupresora, la menor perfusión esplénica por hipovolemia y la pérdida de un componente del complemento (factor B-properdina) que opsoniza determinadas bacterias(30). La peritonitis primaria es la infección más frecuente sin dejar de lado las infecciones pulmonares, cutáneas, urinarias, meningoencefalitis y sepsis (24,41). El Streptococcus pneumoniae es el agente causal más frecuente pero también pueden encontrarse bacterias gram-negativas y Haemophilus(35,36). Entre el 15 y 50% de cultivos de líquido peritoneal son negativos. Los principales síntomas de esta complicación son dolor abdominal, fiebre, irritabilidad peritoneal, náuseas y vómitos. Los esquemas de tratamiento varían según los centros hospitalarios especializados recomendándose penicilina asociada a un aminoglucósido o cefalosporina de tercera generación. Gorensek (37) reportó en una serie de 214 casos nefróticos, 62 episodios de peritonitis en 37 pacientes (17%) y en otra serie de 351 niños seguidos durante 10 años se hallaron 24 episodios de peritonitis en 19 pacientes (6% de los casos). En un tercer grupo de 399 niños se reportó un 5,5% de casos de peritonitis primaria. Un estudio retrospectivo en 34 pacientes en el ISN mostró como complicaciones más frecuentes celulitis, peritonitis, ITU, pansinusitis entre otros observándose que la desnutrición jugó un rol importante ya que las complicaciones eran llamativamente más frecuentes en aquellos con actividad sin tratamiento, que los activos con corticoterapia de quienes supuestamente su estado inmunológico estaría más comprometido(38).
- Trastornos tromboembolicos: Addis en 1948 describió a la asociación de hipercoagulabilidad y el síndrome nefrótico. Kendall y colaboradores encontraron niveles elevados de fibrinógeno, factores V, VII VIII y X, trombocitosis moderada y generación acelerada de tromboplastina en el adulto nefrótico. Almagro y otros, por su parte estudiaron 20 niños nefróticos en recaída y a excepción de un caso todos presentaron alteraciones de la coagulación y la función plaquetaria(39). La hiperfibrinogenemia fue el hallazgo más frecuente y en 22% mostró trombocitosis. La trombosis de la vena renal es la complicación tromboembólica más frecuente en el nefrótico. La trombosis de la arteria renal es muy rara aunque hay reportes de trombo pulmonar además de la femoral, mesentérica, axilar, oftálmica, carótida y cerebral. El 80% de los nefróticos tienen niveles bajos de antitrombina III asociado a la mayor frecuencia de tromboembolismo(43,45). También se describe disminución de la alfa-2 antiplasmina y la proteína S libre en el 50% de los casos.
- Hipovolemia: Clásicamente se planteó que el SN se acompaña de hipovolemia, sin embargo un 50% de pacientes son euvolémicos, 35% hipovolémicos y un 15% hipervolémicos. Asimismo se puede clasificar a los pacientes nefróticos en dos grupos: uno vasoconstrictor con alta actividad de renina plasmática, hipovolemia y hematocrito elevado y el otro con hipervolemia, hematocrito bajo y supresión de la actividad de renina.
- Insuficiencia renal aguda idiopatica reversible: Es consecuencia de una disminución importante de la volemia, trombosis bilateral de las venas renales, pielonefritis, HTA severa o disfunción inducida por drogas. Esta condición clínica de falla renal visto en SNCM ha sido evidenciada en anasarca, proteinuria masiva, y oliguria(39,42,44).
TRATAMIENTO
Principios generales.-
Dieta: Se recomienda reposo, restricción hídrica y una dieta declorurada, normoproteica e hipercalórica. Hay reportes que sostienen que un aporte proteico adicional en la dieta no incrementa significativamente la concentración de albúmina plasmática(10). Las dietas bajas en proteínas disminuyen la albuminuria pero tienen un alto riesgo de desnutrición. En caso de hipocalcemia adicionar carbonato de calcio a dosis de 50-100 mg/Kg/d(46,47).
Antibióticos: Es necesario investigar cualquier foco infeccioso potencial o evidente. Considerar peritonitis, sepsis y las celulitis por infecciones estreptocócicas o estafilocócicas. Se recomienda la utilización profiláctica de penicilina oral en todo niño con ascitis severa. Debe considerarse además la posibilidad de problemas otorrinolaringológicos, dérmicos, caries dental, ITU y parasitosis intestinal(48,50).
Diuréticos: Pueden utilizarse diuréticos además de la restricción de sal (49). Se recomienda furosemida (1-5 mg/Kg/d) o hidroclorotiazida (2-5 mg/Kg/d) posiblemente combinado con un ahorrador de potasio como espironolactona (1-2 mg/Kg/d) o amiloride (0,3-0,5 mg/Kg/d). Hay experiencia del uso de manitol en el edema refractario(51,52).
Infusiones de albúmina: El manejo incluye albúmina humana 0,5 a 1 g/Kg o plasma 10 mL/Kg en 2 horas conjuntamente con furosemida a 3 mg/Kg/d. La precaución está relacionada a la sobrecarga de volumen y precipitar un edema agudo de pulmón.
Presión arterial: El niño con SN es usualmente normotenso. La hipertensión puede reflejar hipervolemia o excesiva respuesta vasoconstrictora en respuesta a hipovolemia. La HTA puede también ser sugestivo de glomerulonefritis.
Tratamiento Farmacológico (Protocolo Servicio Nefrología ISN).-
Está tipificado de acuerdo a la respuesta a esteroides y al patrón histológico (Tabla 2):
Tabla 2. Definiciones
 ( Click en la imgen para ampliar)
( Click en la imgen para ampliar)
Esquema estándar:
- Prednisona 60 mg/m2/día por 4 semanas, seguido de
- Prednisona 40 mg/m2 interdiario por 4 semanas
Esquema Alargado:
- Prednisona 60 mg/m2/día por 6 semanas seguido de
- Prednisona 40 mg/m2 interdiario por 6 semanas
Esquema Acortado:
- Prednisona 60 mg/m2/día hasta obtener en 3 muestras consecutivas de orina la negativización de proteinuria seguido de
- Prednisona 40 mg/m2/interdiario hasta la normalización de niveles de albúmina sérica.
- En el primer episodio se recomienda el esquema alargado.
- En el recaedor infrecuente, la tendencia actual es el esquema acortado.
- En el recaedor frecuente y en el corticodependiente se indica.
Prednisona 40 mg/m2/interdiario asociado a un inmunosupresor.
• Ciclofosfamida 2-3 mg/kg/d; dosis acumulativo entre 180-270 mg/Kg.
• Clorambucil 0,15-0,2 mg/Kg/d dosis acumulativa 9-18 mg/Kg.
• Ciclosporina 2-5 mg/Kg/d, luego de no haber respuesta a los anteriores. - En corticoresistente existen dos posibilidades:
• Pulsoterapia triple con metilprednisolona/prednisona/agente alquilante
• Ciclosporina A + Prednisona (48,50, 52, 54).
PRONÓSTICO
El seguimiento en niños con SN ha sido estudiado en forma extensa. Es recomendable al alta controles semanales que incluye peso, talla, PA y determinación de proteinuria en orina de 24 horas, relación proteína/ creatinina o el ácido sulfosalicílico -ASS- (Tabla 3), y puede realizarse cada 15 días. Debe completarse el seguimiento con parámetros bioquímicos como urea, creatinina, calcio, albúmina y colesterol. En el caso de uso de ciclofosfamida y clorambucil debe realizarse un recuento leucocitario periódico. Considerar toda intercurrencia infecciosa y tratarla. En muchos niños se observa la remisión completa después de la terapia esteroidea considerando además las múltiples exacerbaciones de la enfermedad. Más del 70% de los niños han tenido uno o más episodios de síndrome nefrótico. Los cambios de los podocitos rápidamente revierten a una apariencia normal posterior a la corticoterapia coincidiendo con la desaparición de la proteinuria (15,53).
Tabla 3. Estimación semicuantitativa de la proteina urinaria por el test de precipitación de ácido sulfosalicilico.
 ( Click en la imgen para ampliar)
( Click en la imgen para ampliar)
Bibliografía
1. Barrat T, Avner E, Harmon W. Pediatric Nephrology. Lippincott Williams & Wilkins 4º ed 1999.
2. Sellarés V. Manual de Nefrología Clínica, Diálisis y Trasplante Renal. Harcourt Brace España 1998.
3. International Study of Kidney Disease in Children. The primary nephrotic syndrome in children. Identification of patients with minimal change nephrotic syndrome from initial response to prednisone. J Pediatr 1981; 98: 561-4.
4. Broyer M, Meyrier A, Niaudet P et al. Minimal changes and focal segmental glomerulosclerosis. Textbook of Clinical Nephrology 2º ed Oxford University Press 1997.
5. Schlesinger P, Sultz H, Mosher W et al. The nephrotic syndrome. Its incidence and implications for the community. Am J Child Dis 1968; 116: 623-32.
6. Sharples P, Poulton J, White R. Steroid responsive nephrotic syndrome is more common in Asians community. Arch Dis Child 1985; 60: 1014-7.
7. Hardwicke J, Scootill J, Squire J et al. Nephrotic syndrome and pollen sensivity. Lancet 1959; 1: 500-2.
8. Meadow S, Sarsfield J. Steroid responsive Nephrotic Syndrome and Allergy: Clinical Studies. Arch Dis Child 1981; 56: 509-16.
9. Striker G, Striker L, D’Gati V. The Renal Biopsy major problems in pathology 3rd. W.B. Saunders Company 1997.
10. Bordes W. Distinguishing minimal change disease from mesangial disorders. Kidney Int 1988; 34: 419.
11. Gordillo G. Nefrología Pediátrica. Mosby Doyma Libros 1996.
12. Churg J, Aviv R, White H. Pathology of the Nephrotic Syndrome. A report for the International Study of Kidney Disease in Children. Lancet 1970; 1: 129.
13. Ortiz A. Factores de permeabilidad vascular en el síndrome nefrótico idiopático. Rev Esp Pediatr 1999; 55: 4-8.
14. International Study of Kidney Disease in Children. Nephrotic syndrome in children: prediction of histopathology from clinical and laboratory characteristics at time of diagnosis. Kidney Int 1998; 159-65.
15. Tune B, Mendoza S. Treatment of the Idiopathic Syndrome: regimens and outcome in Children and Adults. J Am Soc Nephro 1977; 8(5).
16. Nash M, Edelmann C, Berstein J et al. Minimal change nephrotic syndrome, diffuse mesangial hypercellularity, and focal glomerular sclerosis. Pediatric Kidney Disease. Little Brown and Co 1992.
17. Sibley R, Mahan J, Mauer M et al. A clinicopathologic study of forty-eight infants with nephrotic syndrome. Kidney Int 1998; 27: 544-52.
18. Tune B, Lieberman E, Mendoza S. Steroid-resistant nephrotic: A treatable disease. Pediatr Nephrol 1996; 10: 772-8.
19. Alon, U. Pediatrics Nephrology. Pediatr Clin North Am 1995; 40(6).
20. Donckerwolke R, Vande Walle J. Pathogenesis of edema formation in the nephrotic syndrome. Kidney Int 1997; 51(Suppl58): S72-S74.
21. Kassirer J. Is renal biopsy necessary for optimal management of the idiopathic nephrotic syndrome? Kidney Int 1983; 24: 561-3.
22. Málaga S, Sánchez M, Santos Rodríguez F: Síndrome Nefrótico en la infancia: características clínicas, terapéuticas y evolutivas en 100 casos. An Esp Pediatr 1999; 31: 220-4.
23. Shaloub R. Pathogenesis of lipoid nephrosis: A disease of T cells function. Lancet 1974; 2: 566-0.
24. Adhikari M, Coovadia H. Abdominal Complications in black and Indian children with nephritic syndrome. S Afr Med J 1993; 83: 253-6.
25. Yamamauch H & Hopner J Jr. Hypovolemic shock of hipotension as a complication in nephrotic syndrome. Report of ten cases. Ann Intern Med 1964; 60: 242.
26. Hoyer P, Gonda S, Barthels M et al. Thromboembolic complications in children con nephrotic syndrome. Acta Pediatr Scand 1986;75: 804-10.
27. Ludmerer KM & Kissane JM. Nephrotic syndrome, nephromegaly, renal hyperfiltration and sudden death in diabetic woman (clinicopathologic conference) Am J Med 1995; 99: 563-72.
28. Ackerman Z. Ascites in nephrotic syndrome. Incidence, patient’s characteristics and complications. J Clin Gastroenterol 1996; 22: 31-4.
29. Welch T, Gianis J & Sheldon C. Perforation of the scrotum complications nephrotic syndrome. J Pediatr 1988; 113: 336-7.
30. Eustace S, Campbell E, Fenell J et al. Erythrocyte sedimentation in nephrotic syndrome. Ir J Med Sci 1988; 157: 380-2.
31. Vara M. Protocolo diagnóstico del síndrome nefrótico idiopático. Rev Esp Pediatr 1999; 55: 99-13.
32. Appel G, Blum C, Chien S et al. The hyperlipidemia of the nephrotic syndrome; relation to plasma albumin concentration, oncotic pressure and viscosity. N Engl J Med 1985;312:1544-8.
33. Trachtman H, Cauthier B, Frank R et al. Increased urinary nitrate excretion in children with minimal change nephrotic syndrome. J Pediatr 1996; 128: 173-6.
34. Heymann W, Boxerbaum B & Makker S. Value of antistreptolysin O titers for differential diagnosis of renal diseases. Int J Pediatr Nephrol 1980; 1: 4-9.
35. Markenson DS, Levine D & Schacht R. Primary peritonitis as a presenting feature of nephrotic syndrome: a case report and review of the literature. Pediatr Emerg Care 1999; 15: 407-9.
36. Kassirer J. Is renal biopsy necessary for optimal management of the idiopathic nephrotic syndrome? Kidney Int 1983; 24: 561-3.
37. Gorensek M, Lebel M, Nelson J. Peritonitis in children with nephrotic syndrome. Pediatrics 1988; 81: 849-56.
38. Sakihara G, Encinas M, Mendoza A et al. Complicaciones del Síndrome Nefrótico Idiopático-Servicio de Nefrología. Instituto de Salud del Niño. VI Congreso Peruano de Nefrología. Lima-Perú 1998.
39. Orth S, Ritz E. The nephrotic syndrome N Engl J Med 1998; 338: 1202-11.
40. Greenberg A et al. Primer on Kidney Disease. 2nd ed National Kidney Foundation 1998.
41. Gulati S, Kher V, Arora P et al. Urinary tract infection in nephrotic syndrome. P Inf Dis J 1996; 15(3).
42. Loghman-Adham M, Siegler R, Pysher T. Acute renal failure in idiopathic nephrotic syndrome. Clin Nephrol 1997; 47: 76-80.
43. Morales San José. Complicaciones del síndrome nefrótico idiopático. Rev Esp Pediatr 1999; 55: 20-26.
44. Durán Alvarez S. Complicaciones Agudas del Síndrome Nefrótico. Rev Cubana Pediatr 1999; 71: 245-53.
45. Wheeker D, Bernard D. Lipid abnormalities in the nephrotic syndrome. Causes, consequences and treatment. Am J Kidney Dis 1994; 23: 331.
46. Peña Carrión A. Tratamiento del síndrome nefrótico idiopático en la infancia. Rev Esp Pediatr 1999; 55: 14-9.
47. Kala V, Milner L, Javcobs D et al. Impact of tuberculosis in children with nephrotic syndrome. Pediatr Nephrol 1993; 7: 393-402.
48. Hoson E, Knight J, Willis N et al. Corticosteroid therapy in nephrotic syndrome: a meta analysis of randomized controlled trials. Arch Dis Child 2000; 83: 45-51.
49. Bargman, J. Management of minimal lesion glomerulonephritis: evidence –based recommendations. Kidney Int Suppl 1999; 70: S3-16.
50. Kasiazek J, Wyszynski T. Short versus long initial prednisolone therapy for initial episode of nephritic syndrome. Acta Paediatr 1995; 84: 8899-993.
51. Agarwal R, Gorski J, Sundblad K et al. Urinary protein binding does not affect response to furosemide in patients with nephritic syndrome. J Am Soc Nephr 2000; 11(6).
52. Lewis, Malcon A. Mannitol and furosemide in the treatment of diuretic resistant oedema in nephrotic syndrome. Arch Dis Child 1999; 80: 184-5.
53. Gregory M, Smoyer W, Sedman D. Long-term cyclosporine Therapy for Pediatric Nephrotic Syndrome. A clinical and histological analysis. J Am Soc Nephr 1996; 7(4).
54. Constantinescu A, Shah H, Edward F et al. Line Predicting first year relapses in Children with Nephrotic. Pediatrics 2000; 105: 492-5.
55. Hogg R, Portmann R, Milliner D et al. Evaluation and management of proteinuria and nephrotic syndrome in children. Recommendations from a pediatric nephrology Panel Established at the National Kidney Foundation Conference of Proteinuria, Albuminuria, Risk, Assessment Detection and Elimination (PARADE). Pediatrics 2000; 5(5).
--------------------------------------------------------------------------------
* Pediatra-Nefrólogo
Médico Asistente del Servicio de Nefrología, ISN.
Síndrome Nefrítico en pediatría
DEFINICIÓN:
La lesión glomerular puede ser el resultado de alteraciones inmunológicas, hereditarias o de la coagulación. La causa más común es la inmunológica y produce una "glomerulonefritis" que es un término genérico, tanto para designar diversas patologías como un término histopatológico que significa inflamación de los capilares glomerulares.
La reacción inflamatoria secundaria a la lesión inmunológica, resulta de la activación de uno o más sistemas de mediadores bioquímicos.
El más importante es el sistema del complemento que tiene dos secuencias: la vía clásica que se activa por complejos inmunes antígeno- anticuerpo y la vía alterna o de la properdina que es activada por polisacáridos y endotoxinas. Estas vías convergen en el C y se producen anafilactotoxinas que aumentan la permeabilidad vascular y los factores quimiotácticos (Cq) que dirigen neutrófilos y al parecer macrófagos al sitio de la activación del complemento donde las células liberan sustancias que dañan la célula vascular y la membrana basal.
El sistema de la coagulación puede ser activado directamente iniciando la cascada de la coagulación o indirectamente siguiendo la activación del complemento. Los depósitos de fibrina se ubican en los capilares glomerulares y en la cápsula de Bowman. Además el sistema de la coagulación puede activar el sistema quinina, que también produce factores quimiotácticos y factores semejantes a las anafilactotoxinas.
La glomerulonefritis puede evolucionar en forma aguda o crónica.
GLOMERULONEFRITIS AGUDA
En pediatría, la glomerulonefritis aguda se caracteriza por ser un síndrome de comienzo brusco con edema, oliguria, hipertensión arterial y alteraciones del sedimento urinario (proteinuria. hematuria y cilindruria).
La forma más frecuente y mejor conocida de glomerulopatía aguda es la glomerulonefritis aguda posestreptocócica (GNAPE).
Es una enfermedad específica que, con pocas excepciones. tiene una etiología bien definida: infección estreptocócica, especialmente por el estreptococo 13-hemolítico del grupo A, y con rasgos clínicos característicos: edema, hipertensión, oliguria, alteración del sedimento urinario, hipocomplementemia, regresión espontánea y pronóstico benigno.
Etiología:
Es conocido el hecho de que una infección estreptocócica faríngea o cutánea precede en 1 a 2 semanas (promedio 12 días) el inicio de la glomerulonefritis. Los estreptococos nefritógenos son los estreptococos (3-hemolítiCos del grupo A (EBHA).
No ha llegado a aclararse en que consiste la propiedad nefritógena. Sólo una pequeña pro porción de los niños infectados con cepas nefritógenas desarrollan la enfermedad clínica (1 de cada 100).
Se ha encontrado con frecuencia la asociación de la glomerulonefritis con los EBHA del tipo Ti-Ml y el Tl4-M0 en los cultivos faríngeos y el Imp 19 en los cultivos cutáneos, pero tambien se han identificado como agentes etiológicos principales el tipo 12, 4.25, 49, 53, 55, 56 y 60.
La existencia de cepas nefritógenas explica la escasa presentación de recurrencias de la nefritis ya que, en respuesta a la infección, se establece una inmunidad que protege al individuo de un segundo ataque, mediante la producción de anticuerpos de tipo específico, siendo baja la probabilidad de una nueva infección con una cepa distinta, también nefritógena. El estreptococo tiene escasa difusibilidad. por ello debe buscarse en el grupo familiar del paciente afectado.
En el grupo familiar se encuentran alteraciones en la orina en el 6% de los adultos y en el 33% de los niños. Esta diferente susceptibilidad explicaría la mayor incidencia de la enfermedad en estos últimos.
Se ha demostrado glomerulonefritis aguda también después de infecciones por estafilococos, neumococos y algunos virus. Hay poca información disponible; sin embargo, su aspecto parece semejar al de la GNAPE
Fisiopatología:
Los estudios de función renal en estos pacientes durante la fase aguda demuestran una disminución importante de la velocidad de filtración glomerular y una disminución menor del flujo sanguíneo renal y de las funciones tubulares.
Estos resultados concuerdan con la imagen histológica al microscopio de luz, en que se encuentra capilares glomerulares obliterados por el edema y la proliferación celular, con muy escasas lesiones tubulares e intersticiales. En estas circunstancias, disminuye el filtrado glomerular y se reduce la cantidad de agua y sodio que se ofrece a los túbulos para su reabsorción.
Como la función tubular está prácticamente intacta se reabsorbe una proporción de filtrado mayor que lo normal, favoreciendo la aparición de un balance positivo que conduce a una pléfora del espacio extracelular, en especial del intravascular y al aumento de la presión venosa central. Son la causa del edema, la hipertensión y la congestión circulatoria y de las complicaciones más temibles y frecuentes en el período agudo de la GNAPE: la insuficiencia cardíaca y la encefalopatía hipertensiva. El mecanismo angiotensina-aldosterona tiene una ingerencia sólo secundaria.
La lesión y la disminución del filtrado glomerular explican también la presencia de albúmina, hematíes y leucocitos en el sedimento urinario, así como la elevación de la tasa de urea en sangre y de creatinina sérica.
Al microscopio electrónico, el glomérulo confirma la impresión histológica de edema y proliferación de las células endoteliales y mesangiales. La membrana basal no aparece visiblemente lesionada o engrosada y los podocitos epiteliales únicamente se fusionan en zonas aisladas.
A intervalos, a lo largo de la membrana basal, se observan depósitos densos que representan complejos antígeno-anticuerpo y complemento precipitados. Con estudios de inmunofluorescencia se muestra depósitos granulares de lgG y C
Epidemiología
La tasa anual de GNAPE por 100.000 habitantes es de 7 en períodos endémicos, pero esta enfermedad evoluciona con brotes epidémicos que pueden más que duplicar esa cifra, llegando a 18 por 100.000 habitantes.
Es propia de los grupos etareos jóvenes: el 95% de los pacientes son menores de 15 años. El 50% tiene entre 5 y 9 años, aunque se presenta desde los 2 años.
Hay un predominio del sexo masculino (57%). Se presenta durante todo el año con alzas estaciónales en otoño (38%) que obedecen a un aumento de la GNAPE de origen cutáneo y en primavera (30%) debido a GNAPE de origen faríngeo. En el período epidémico la distribución es homogénea durante todo el año.
Es más habitual en grupos familiares con mayor grado de hacinamiento y promiscuidad.
Las cifras de mortalidad revelan un descenso desde 91 muertos en 1970 hasta 21 en 1981. No se registran defunciones en la década de 1990 debido a un diagnóstico más oportuno y al tratamiento adecuado de las complicaciones.
Cuadro clínico
El antecedente de infección estreptocócica cutánea (piodermitis) mes cada día ás común como causa de nefritis, sobrepasando el 50% del total. El origen respiratorio alto (la amigdalitis pultácea) le sigue en frecuencia.
Otro antecedente que es necesario investigar es la escarlatina, de la cual suele observarse, en el momento del inicio clínico de la nefritis, la descamación laminar. En ocasiones, sirven como puerta de entrada para la infección estreptocócica: abscesos dentarios, incisiones quirúrgicas o lesiones de varicela o de dermatitis atópica.
En un grupo de pacientes, la historia de infección estreptocócica (lE) previa no se precisa, pero en la mayoría de los casos puede demostrarse en el laboratorio por medio de cultivos o estudios serológicos.
Alrededor de 2 semanas después de la infección estreptocócica, la enfermedad comienza a manifestarse por edema palpebral matutino; posteriormente se extiende al abdomen y extremidades.
La anasarca es excepcional. La orina es escasa en volumen, turbia y de un color más café que rojo. Los padres suelen describirla comparándola con té cargado, agua de carne lavada o bebida cola. La hematuria es total y sin coágulos.
A la exploración, el niño con nefritis aguda suele estar pálido, aletargado, inapetente y afebril. Si aparece alza térmica debe investigarse el foco causal, por lo general otitis o neumonías.
Deben buscarse los signos de lE reciente o activas tales como exudado amigdalino, adenitis cervical, descamación cutánea laminar en las extremidades, y lesiones o cicatrices de piodermitis. El pulso suele ser más lento que lo normal.
Es frecuente una hipertensión arterial ligera o moderada: sobre el percentil 95 correspondiente para la edad. Es posible la elevación súbita de la tensión arterial, que puede llegar a cifras peligrosas y dar síntomas de insuficiencia cardíaca o encefalopatía hipertensiva. El fondo de ojo suele ser normal, como todo el resto de la exploración, si no se han presentado complicaciones. La urea sanguínea puede estar elevada.
El primer signo de mejoría es el aumento de la diuresis, con la consiguiente baja de peso. Al cabo de 24-72 horas comienza una poliuria abundante. La hipertensión se normaliza a medida que desaparece el edema, aunque puede persistir hasta el fin de la fase poliúrica.
Complicaciones de la fase aguda
Durante la fase aguda pueden presentarse tres tipos de complicaciones: insuficiencia cardíaca, encefalopatía hipertensiva e insuficiencia renal aguda.
Insuficiencia cardiaca: Los niños con glomerulonefritis aguda e hipertensión tienen un pulso bradicárdico. Toda frecuencia cardíaca sobre lOO debe considerarse como insuficiencia cardiaca, por lo menos potencial. Cuando ya se ha producido la complicación se advierten: ortopnea. ingurgitación venosa del cuello, ritmo de galope y hepatomegalia dolorosa, signos de retención sódica y congestión circulatoria con agrandamiento cardíaco y aumento de la trama vascular p en la radiografía de tórax. La insuficiencia cardíaca se encuentra presente al ingreso.
Los síntomas premonitorios de encefalopatía son: cefalea, mareos. molestias abdominales y vómitos, que pueden seguir de pérdida transitoria de la visión, hemiparesias. desorientación y convulsiones tipo Gran mal.
La presión del líquido cefalorraquídeo está elevada, pero el líquido es normal. No se debe realizar punción lumbar como prueba diagnóstica por el peligro de la compresión bulbar con paro cardíaco. La encefalopatía se presenta en el 3% de los GNAPE y su recuperación suele ser completa.
La insuficiencia renal aguda es una complicación rara (0,5%). La oliguria extrema habitualmente no dura más de 24-48 horas, por lo que no suelen presentarse las alteraciones bioquímicas propias de la insuficiencia renal aguda.
Exámenes Complementarios
Examen de orina: Durante el período de latencia de la enfermedad, suele ser normal, o con hematuria microscópica. En la fase aguda edematosa, la orina disminuye en volumen y la densidad no sobrepasa los 1.020. La albuminuria no suele llegar a 1 g%. No hay glucosuria.
El sedimento presenta un número aumentado de hematíes, leucocitos, células epiteliales y cilindros. Debe observarse la orina reciente si se quieren encontrar cilindros hemáticos porque se destruyen con facilidad. La albuminuria y la hematuria microscópica pueden persistir durante un tiempo.
Hemograma: Hay un descenso moderado de la hemoglobina y del hematócrito durante la fase edematosa. Se trata de una anemia normocítica-normocromica. Se pensaba que esto se debía exclusivamente a la hemodilución que producía la hipervolemia.
Ahora se sabe que también interviene una disminución de la eritropoyetina y de la ferritina. Es importante que el médico reconozca el carácter benigno y transitorio de esta anemia, pues no requiere tratamiento. De hecho, el tratamiento sólo complicaría la hipervolemia. pudiendo precipitar una insuficiencia cardiaca. El recuento y la fórmula leucocitaria y plaquetaria son normales.
Química plasmática: El sodio, potasio, cloruro y bicarbonato plasmático son normales, excepto en enfermos con insuficiencia renal aguda en que se presentan los trastornos propios de dicho cuadro. La urea se eleva rara vez sobre 1 g%. La creatinina plasmática asciende también moderadamente.
Bacteriología: En general, la presencia del EBHA en cultivos faríngeos es de escaso rendimiento, En nuestra casuística no Supera el 30% de los enfermos hospitalizados. En los cultivos de piel la tasa de aislamiento del EBHA fue del 60 por ciento.
Serología e inmunología: La prueba serológica más empleada es la determinación del título de antiestreptolisina O (ASO). Un título elevado significativo o una elevación del título en pruebas repetidas confirman la existencia de una infección estreptocócica previa.
Comienza a elevarse a los 7 días de la infección, llegando a su valor máximo entre 3 o 5 semanas después. El antibiótico dado al inicio de la infección estreptocócica puede abortar la respuesta inmunológica.
En nuestra investigación, se incorporó dentro del estudio serológico la prueba de la anti-DNasa B. Sabemos que los títulos varían enormemente según sea la situación epidemiológica que se esté viviendo.
Los títulos que entrega la American Heart Association como normales no son aplicables a la situación chilena en que se encontraron como cifras normales para la anti-DNasa B. 240 U. Los estudios americanos dan como normal lOO U (3 diluciones menor).
En la GNAPE el 50% de las ASO y el 76% de la anti-DNasa B están elevadas en forma significativa. El menor rendimiento de la ASO está explicado por la alta frecuencia de localización estreptocócica cutánea, en que el poder inmunogénico del estreptococo es inhibido por la grasa cutánea y no se estimula la producción de anticuerpos.
La presencia de estos anticuerpos en la circulación sólo sirve para confirmar una infección estreptocócica reciente. Carecen de valor para estimar la gravedad o para seguir el curso de la nefritis aguda.
El complemento sérico (C baja a los 15 días de la infección estreptocócica, coincidiendo con el inicio de la fa se aguda edematosa y se normaliza 4 a 6 semanas después. Los valores normales son de 150 ± 50 mp.
El estudio de C es un elemento útil en el diagnóstico de la GNAPE, ya que en pediatría, salvo el lupus eritematoso y la glomerulonefritis hipocomplementémica, ambos de baja frecuencia en la infancia, es la única nefropatía que cursa con C bajo. La velocidad de’ sedimentación globular es inespecífica y su elevación y normalización no tienen una correlación directa y. por ende pronóstica. con la evaluación de la enfermedad, como se describió en adultos.
Otros Exámenes: En caso de complicaciones se necesita radiografía de tórax, electrocardiogramas, etc. La biopsia renal es necesaria para confirmar casos de nefritis aguda atípica; también sirve para descartar la existencia de una nefropatía crónica.
Formas atípicas de presentación
Algunos casos de Glomerulonefritis aguda post Estreptocócica se inicia de manera atípica con signos y síntomas de afectación aguda de sistema cardiovascular o del Sistema nervioso central; que enmascara las manifestaciones propias de la neuropatía; o alteraciones mínimas o nulas de sedimentos urinarios, o hematuria.
Tratamiento
No hay tratamiento específico, pero en casi todos los casos se produce la evolución hacia la curación espontánea, si se maneja correctamente la fase hipovolemica edematosa.
La restricción en la dieta de líquidos, junto con la utilización de fármacos para prevenir y tratar las complicaciones, ha reducido de modo considerable el número de muertes que se producía anteriormente en las fases iniciales de la enfermedad.
Medidas Generales:
* Reposo en cama: El grado de restricción de la actividad debe variar con la gravedad de las manifestaciones clínicas.
En casos con hipertensión y congestión circulatoria el reposo en cama es estricto por el peligro de insuficiencia cardiaca. El reposo en cama se mantiene hasta que el edema desaparezca y se estabilice el peso y la presión arterial en sus niveles se normalicen.
* Balance hídrico: La ingestión de agua no debe exceder la capacidad excretora del riñón. El mejor índice control del balance hídrico es el peso diario durante la fase aguda edematosa, hasta que el peso se estabilice las cifras previas a la enfermedad.
* Dieta: Durante la fase edematosa puede ser necesaria la restricción en el contenido de sodio, potasio y proteínas de la dieta. El sodio debe reducirse en todos los niños con edema e hipertensión. El potasio debe ser sistemáticamente reducido en la dieta en los primeros días hasta que se compruebe que no hay oliguria extrema o anuria. Las proteínas se eliminan a 0.5 g/kg/dia cuando hay uremia. Cuando la diuresis y la uremia llegan a lo normal, deben suspendérselas medidas restrictivas.
Tratamiento especifico:
* Infección Estreptocócica: Se trata en forma temprana las infecciones con penicilina. Sin embargo, muchas veces las infecciones son tan leves o de tan corta duración que los padres no recurren al medico. No obstante conviene tratar todos los casos con infecciones de faringe de piel producida por estreptococos beta hemolítico para evitar el contagio de infección a otros miembros de la familia.
Debe tratarse en forma profiláctica con penicilina todos los miembros de la familia donde puede estar el microorganismo involucrado. Este manejo profiláctico es menor en niños de 15 años por ser el grupo más proclive a la enfermedad.
* Hipertensión Arterial: Si la hipertensión es importante y no cedo con las medidas generales se indicaran diuréticos de acción rápida (Flurosemida, 5 mg/kg por dosis). Lo habitual es que la acción diurética sea efectiva a los 20 minutos.
* Insuficiencia Cardiaca: Por ser secundaria a la hipervolemia responde al tratamiento con diuréticos.
* Insuficiencia Renal Aguda: Suele ser de corta duración, se trata con intercambio iónico y la diálisis peritoneal.
Evolución y Pronóstico: El alta esta condicionada por la caída de la presión arterial a los limites normales, la fusión de los edemas, comprobada por la estabilización del peso durante mas de 3 días y la desaparición de la hematuria macroscopica.
La hematuria y la proteinuria sirve para indicar la gravedad, ya que la presencia de proteinuria durante mas de 6 meses o de una hematuria mas allá de del año no significa que paso la enfermedad a cronicidad.
GLOMERULONEFRITIS CRONICA
Es un grupo de Enfermedades renales que comparten las siguientes características:
- No tienen causa etiológica.
- Afecta predominantemente el glomérulo.
- Las manifestaciones clínicas y de laboratorio se prolonga en el tiempo.
- El daño histológico es característico pero son patognomónico.
- Puede ser producido como parte de patologías renales o extrarenales que tiende a evolucionar a insuficiencia renal.
Dos mecanismos inmunológicos dañan crónicamente el glomérulo:
- Complejos inmunes formados fuere del riñón o depósitos en el o formados en el riñón por la unión del antigeno renal propio o implantado que se une con anticuerpos circulantes. Los complejos inmunes son depositados bajo el endotelio del riñón, activando probablemente el sistema de complemento, quininas, y se producen sustancias que atraen a leucocitos, lo que a su vez entrega sustancias proteolíticas. Además, hay productos inflamatorios como anafilotoxinas que alteran la permeabilidad de la membrana basal.
- Enfermedad glomerular producida por anticuerpos anti membrana basal.
Se reconoce seis tipos de Glomerulonefritis Crónica:
◦Glomerulonefritis Mesangiocapilar.
◦Glomerulonefritis focal o segmentaria.
◦Glomerulonefritis extramembranosa.
◦Glomerulonefritis crescentica.
◦Glomerulonefritis por IgA.
◦Nefrosis Lipoidea.
Glomerulonefritis Mesangiocapilar:
También llamada Glomerulonefritis parientoproliferativa. Es la causa más importante de Glomerulonefritis Crónica en adolescentes y en adultos jóvenes, aunque puede encontrarse a cualquier edad. Hay dos tipos: La GN Mesangiocapilar tipo I con depósitos subendoteliales y la tipo II con depósitos intramembranosos.
La presentación Clínica abarca la gama completa de síndromes nefrologicos, pudiendo presentarse como proteinuria aislada, hematuria, la hipertensión es un hallazgo frecuente y la función renal tiene compromiso muy variable en el momento del diagnostico.
Esta gran variedad del cuadro clínico dificulta la formulación del diagnostico correcto. Una de las características mas llamativas del laboratorio es el hallazgo en mas del 70% de los casos de depresión de de los niveles del complemento c3 y del complemento Hemolítico.
El cuso clínico es lentamente progresivo hacia la falla renal. Las lesiones histológicas son siempre progresivas siendo por lo general la tipo II la más agresiva.
Glomerulonefritis Focal y Segmentaria
Llanada también hialinosis focal y segmentaria. Clínicamente puede presentarse como proteinuria aislada, pero es mas frecuente como síndromes nefríticos.
En la fase inicial puede aparecer con síndrome nefrítico puro, sin alteraciones del sedimento, hipertensión ni compromiso de la función renal que induce el diagnostico de nefrosis lipoidea. Puede tener remisiones espontáneas, el curso habitual es a la insuficiencia renal.
Glomerulonefritis Extramembranosa.
En esta nefropatía no hay inflamación, la forma idiopática es la mas común, y la forma secundaria esta relacionada con enfermedades sistémicas (Lupus, Artritis Reumatoide), infecciones (Hepatitis B), neoplasia (colon, estomago y pulmón) y drogas (sales de oro, penincilaminas).
En el comienzo la proteinuria puede ser el único hallazgo, pero es mas frecuente la asociación con hematuria microscópica, hipertensión moderada y compromiso variable de la función renal. Por lo general el curso de la enfermedad es de muy lenta progresión a la insuficiencia renal.
Glomerulonefritis Rapidamente Progresiva
Llamada también glomerulonefritis rápidamente progresiva, GN extracapilar o conformación de semilunas, es la forma más agresiva de las glomerulonefritis. Su historia natural es la progresión rápida hacia la insuficiencia renal terminal.
La forma idiopatica se clasifica en tres grupos de acuerdo con la inmunofluorescencia: con anticuerpos antimembrana basal (IN lineal), la mas comun enniños, por complejos inmunes (IN granular) y sin evidencia de depositos inmunológicos (IN negativa).
Hay formas secundarias asociadas a enfermedades sistémicas: infecciones (estreptococicas, hepatitis B) o multisistemicas (lupus, síndrome de Goodpasture, purpura de Schönlein-Henoch, vasculitis, etc).
Desde el punto de vista clínico su presentación es el síndrome nefrítico con hipertensión arterial de difícil manejo y proteinuria que con frecuencia alcanza el rango nefrótico. La función renal está comprometida desde el comienzo y la evolución es progresiva hacia la falla renal en el transcurso de semanas o meses.
La biopsia renal, después de proporcionar el diagnostico de la enfermedad, permite visualizar elementos que condicionan su pronostico, como: compromiso de mas del 80% dela superficie glomerular, atrofia tubular severa con fibrosis intersticial y fibrosis glomerular extensa. La presencia de estos hallazgos histológicos son de mal pronostico para la función renal.
El tratamiento mas usado es la metilprednisolona, seguido de prednisona. La mayoría de los autores asocian inmunosupresores y anticoagulantes y muchos rercomiendan la plasmaferesis repetida. Estos tratamientos requieren hospitalización del paciente y el cuidado de un equipo medico familiarizado con los riesgos en con el uso de estas drogas. La instalación de estas medidas debe ser temprana.
La enfermedad tiende a recidivar en el transplante renal (10 – 30%), que debe hacerse después de un tratamiento prolongado con inmunosupresores. La nefrectomía bilateral previa al transplante no ha demostrado clara utilidad.
Nefropatía por IgA
La llamada también enfermedad de Berger, se caracteriza por la presencia predominante de IgA en el mesangio del glomérulo, pero también se encuentran cantidades menores de IgG, IgM, C3 y properdina.
El diagnostico como nefropatía primaria (idiopática) exige la exclusión de enfermedades sistémicas capaces de producir el mismo cuadro en el estudio con inmunofluorescencia, como la púrpura de Schönlein-Henoch, la artritis reumatoide seronegativa, la enfermedad de Crohn y algunas neoplasias. Su frecuencia es variable. Afecta sobre todo hombres en relación 2:1.
Clínicamente se manifiesta en su forma más corriente como hematuria macroscópica, que comienza muchas veces con una infección respiratoria alta, acompañándose de malestar y dolor lumbar de variable intensidad (cuadro "gripal o viral"). A veces la hematuria aparece con el ejercicio físico.
Suele haber normotensión, la función renal esta conservada y C3 normal, lo que hace fácil diferenciarlo de la GNAPE. La hematuria macroscópica dura 2 a 5 días y pasa, pero el sedimento revela persistencia de hematuria microscópica acompañada o no de proteinuria. En el 10% de estos pacientes la proteinuria alcanza rango nefrótico.
La hematuria tiende a repetirse pero la evolución de la enfermedad es habitualmente benigna, con la función renal estable por muchos años.
En algunos casos se llaga a insuficiencia renal en el curso de pocos años; esta modalidad evolutiva se asocia con el hallazgo histológico de crescentes en los glomérulos.
No existe tratamiento conocido. Esta en proceso de evaluación el uso de ácidos grasos poliinsaturados omega 3. En el transplante, la nefropatía por IgA puede recidivar, pero como su evolución es benigna no lo contraindica.
Bibliografía
1.- MENEGHELLO, Julio. Pediatría, Quinta Edición. Buenos Aires. Editorial Médica Panamericana, 1997.
2.- BENNETT, Claude. Tratado de Medicina Interna, Vigésima Edición. México. Editorial Mc Graw-Hill, 1997.
PABLO VERA
Estudiante 5to año de Medicina. LUZ
doctorgolpista[arroba]hotmail.com
LA UNIVERSIDAD DEL ZULIA
FACULTAD DE MEDICINA - ESCUELA DE MEDICINA
PUERICULTURA Y PEDIATRIA
HOSPITAL CHIQUINQUIRÁ
MARACAIBO, DE OCTUBRE DE 2004